恭贺本所罗翊祯教授及博班生张舜延与中研院细生所高承福副研究员实验室团队合作,发表论文刊登于国际期刊《自然通讯》(Nature Communications)。
狭路相逢:组蛋白修饰扮演「分子减速丘」缓解DNA上的交通冲突
Nat Commun. 2020 Feb 10;11(1):809. doi: 10.1038/s41467-020-14595-4.
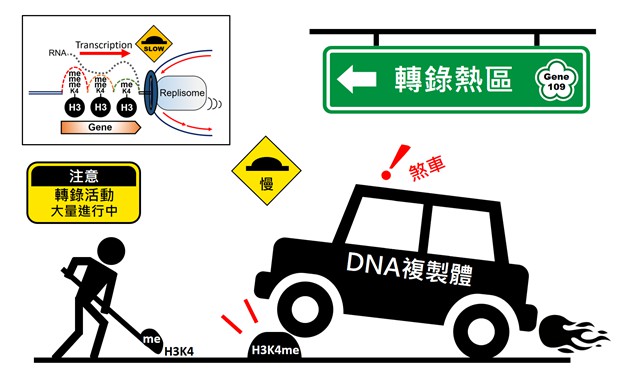
「分子减速丘」:基因上的组蛋白会因转录活动而累积H3K4me标记。当DNA复制组通过该区域时,会因为标记的存在而降低前进速率,缓解了与转录组之间的冲突。
DNA复制与RNA的转录都是维持生命的必备机制,二者都以DNA作为模板,利用上面的遗传讯息,作为复制与转录的依据。然而,当这两个作用在细胞周期的DNA复制时(S期)无可避免地在同个DNA模板上相遭遇,导致RNA转录-DNA复制冲突(transcription-replication conflict;TRC),造成DNA模板的损害机率提高,并可能导致基因突变。国立台湾大学生农学院食科所罗翊祯教授与中研院细生所高承福副研究员实验室团队透过酵母菌发现高强度转录的基因上的组蛋白H3的甲基化修饰(H3K4me)可以抑制在DNA复制压力下因TRC所造成的基因突变。此研究成果不仅为困扰学界多年的「H3K4me功能之谜」增添了一块重要拼图,同时解释了临床上的人类细胞在缺乏H3K4me会演变成癌细胞的可能原因。此论文已于今(2020)年2月10日刊登于国际期刊《自然通讯》(Nature Communications)。
目前学界已知细胞在面对TRC当下,必须有效率地放弃转录活动,以“让道”DNA复制体顺利通过,避免复制体停滞造成DNA结构上的崩塌。但是,在转录活动极旺盛的基因上,此“让道”机制有可能不足以充分调解源源不绝转录活动,造成剧烈的TRC,因此导致相较一般基因区域有着更高的突变风险。TRC在原核细胞中频繁发生,系促进细菌演化与逆境适应的机制之一。在真核生物细胞内,因TRC造成的基因突变并不如原核细胞般频繁,然而详细的机制至今未解。典型的H3K4me标记在基因组上的组蛋白,其含量从基因的起始端至末端呈现高至低的渐层,此一现象一直以来被认为与转录调控及转录记忆有关。然而事实上,这修饰标记会随着转录活动而被持续叠加在基因组上,明显是基因表现的副产品,所以其确实功能为何迄今都未有统一且圆满的解释。
研究团队首先发现酵母菌细胞在失去H3K4me后,DNA复制体前进的速率有变快的现象。研究团队因此提出了「减速丘模型」来描述所观察的现象。顾名思义,「减速丘」系意指H3K4上的甲基化修饰,会对稳定前进的复制体带来减速效果,但对不稳定的复制体则会带来致命的后果,犹如性能正常的车子能减并速稳定地通过减速丘,而刹车失灵或失控中的车子则会冲撞减速丘导致悲剧发生。
为何真核细胞内需要这类「减速丘」来减缓复制体前进?团队的进一步研究发现这一切是真核细胞中的精巧设计!由于H3K4me这「减速丘」会随着转录的次数累积在基因的组蛋白上,意味着越是活跃的基因上会被设置了越多的「减速丘」。当「车子」(复制体)通过转录活性活跃的区域,会因为这些「减速丘」而慢下来,进而缓解了与转录组在相同DNA片段上的冲突,减少模板的损伤并降低基因突变的机率。这个假说已经透过实验验证,团队发现当细胞面对DNA复制压力时,活跃的基因发生突变的机率会因为「减速丘」的存在而降低,而相对不活跃的基因之突变率则不会因「减速丘」的存在与否而有改变,显示细胞在转录过程中,尤其是在高度活跃的转录区域,设置「减速丘」像是为了对准备通过的复制体「警示」说:“前面有大量转录体,请减速避免意外”。
本研究在「为何转录体要在基因上标记H3K4me」的谜题上提供了一个合理且生动的解释,未来将朝着H3K4me是如何形成「减速丘」的分子机制做进一步探讨。
本文第一作者张舜延为台大食科所博士生,由台大食科所罗翊祯教授与中研院细生所高承福副研究员共同指导。本研究团队包括台大医学院生化分生所林敬哲教授、中研院资讯所蔡怀宽研究员与蔡政宏、美国Fred Hutchinson Cancer Research Center的Sue Biggins研究员、Toshio Tsukiyama研究员与Sam Cutler博士。研究经费来源来自台大/中研院联合办公室、中研院、科技部,美国国家卫生研究院(NIH)与霍华德·休斯医学研究所(HHMI)。
此论文的标题为“H3K4 methylation at active genes mitigates transcription-replication conflicts during replication stress”











